/ News
Wie Bakterien ihren Schutzschild stärken
Forschende der Universität Basel haben einen neuen Mechanismus entdeckt, mit dem Bakterien sicherstellen, dass ihre äussere Zellhülle auch bei widrigen Umständen intakt und funktionsfähig bleibt. Dieser Mechanismus ist für das Überleben von Krankheitserregern im befallenen Organismus wichtig. Die Studie liefert neue Einblicke zur Bekämpfung von Infektionen.
Bei der Infektion ihres Wirtes müssen Krankheitserreger nicht nur der Immunabwehr trotzen, sondern auch mit unterschiedlichsten Lebensbedingungen zurechtkommen, wie dem sauren Milieu im Magen oder der salzreichen Umgebung im Darm. Gramnegative Bakterien, zu denen auch zahlreiche Krankheitserreger gehören, schützen sich mit einer zusätzlichen äusseren Zellmembran vor schädlichen Einflüssen.
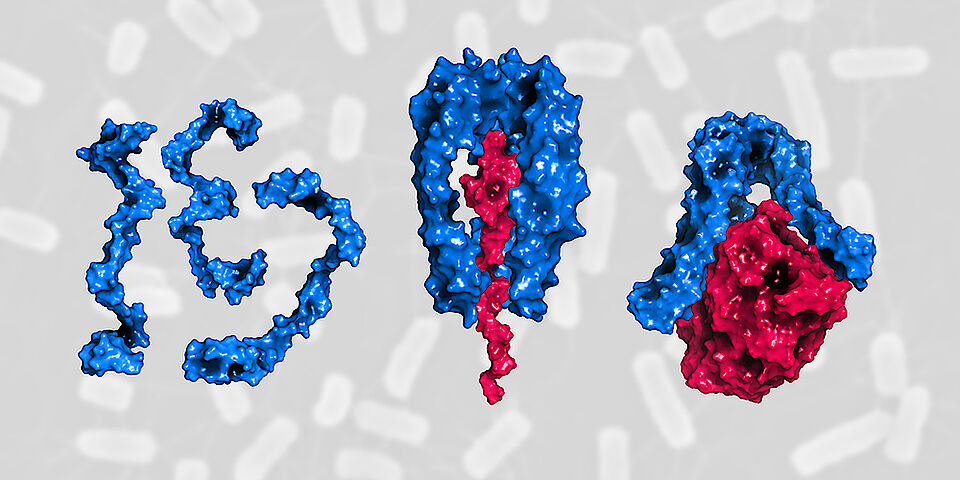
Damit Bakterien auch ungünstige Bedingungen überstehen, müssen sie beschädigte Proteine der äusseren Membran fortlaufend ersetzen und das Arsenal an Proteinen dem jeweiligen Bedarf anpassen. Dafür sorgt das bakterielle Protein Skp. Mithilfe der atomaren Struktur dieses Faktors konnten die Forscher um Prof. Dr. Sebastian Hiller vom Biozentrum der Universität Basel nun aufklären, wie er sich selbst aktiviert. In Zusammenarbeit mit Prof. Dr. Dirk Bumann konnten sie am Beispiel von Salmonellen zeigen, dass Skp für die Virulenz und das Überleben von Erregern in lebensfeindlichen Milieus des Wirtes wichtig ist. Davon berichten die Forschenden im Fachblatt «Science Advances».
Shuttle-Service für Proteine
«In der Bakterienzelle bietet Skp eine Art Shuttle-Service. Es bringt neu synthetisierte und noch ungefaltete Membranproteine unbeschadet von der inneren zur äusseren Membran», erklärt Hiller. Ohne die Hilfe von Skp würden diese Proteine im dazwischenliegenden wässrigen Spalt verklumpen und wären daher unbrauchbar. Da der Umsatz an Membranproteinen zum Beispiel bei widrigen Einflüssen und Zellstress plötzlich und rapide ansteigen kann, müssen in der Zelle immer genügend Skp-Shuttle abrufbereit sein.
Wie dies gelingt und wie Skp seine eigene Aktivität steuert, zeigen die Forscher nun erstmals in ihrer Arbeit. «Im Zwischenspalt gibt es eine grosse Menge einzelner Skp-Proteine, die unstrukturiert und deswegen inaktiv sind», sagt Dr. Guillaume Mas, Erstautor der Studie. «Bei Stress werden aus diesem Pool sehr schnell viele Skp-Proteine rekrutiert. Aktiv werden sie, indem sich drei Proteine miteinander verbinden und eine stabile Struktur um das zu transportierende Protein herum bilden; wie eine Käseglocke um den Käse. Nur so kann Skp seine Shuttle-Funktion ausüben.» Sobald dieses Dreiergespann, Trimer genannt, seine Fracht am Zielort entladen hat, zerfällt es in seine Einzelteile, die dann wieder für den nächsten Shuttle zur Verfügung stehen.
Proteinfunktion beeinflusst Überlebensrate
Bei stressbedingt hohem Transportaufkommen von äusseren Membranproteinen verschiebt sich das Gleichgewicht von inaktivem Einzelmolekül in Richtung aktives Trimer. Diese streng kontrollierte Aktivierung ist für Bakterien lebenswichtig, denn sie verhindert unter anderem, dass bei Stress unlösliche Protein-Aggregate entstehen, welche die Zelle schädigen.
Salmonellen mit einer gestörten Skp-Funktion sind im Nachteil, das zeigten Untersuchungen im Tiermodell. Mutationen im Protein, die die Trimer-Bildung verhindern, bremsen das Wachstum und senken die Überlebensrate der Bakterien im Wirt. Diese neuen Erkenntnisse zur Rolle der äusseren Membran bezüglich der Widerstandsfähigkeit von Bakterien sind bedeutend für die Behandlung von Infektionskrankheiten.
Originalbeitrag
Guillaume Mas, Björn M. Burmann, Timothy Sharpe, Beatrice Claudi, Dirk Bumann, Sebastian Hiller
Regulation of chaperone function by coupled folding and oligomerization
Science Advances (2020), doi: 10.1126/sciadv.abc5822
Weitere Auskünfte
Prof. Dr. Sebastian Hiller, Universität Basel, Biozentrum, Tel. +41 61 207 20 82, E-Mail: sebastian.hiller@clutterunibas.ch
Dr. Katrin Bühler, Universität Basel, Kommunikation Biozentrum, Tel. +41 61 207 09 74, E-Mail: katrin.buehler@clutterunibas.ch